Η θερμοδυναμική είναι ένας σημαντικός κλάδος της φυσικής. Μπορούμε με ασφάλεια να πούμε ότι τα επιτεύγματά του οδήγησαν στην εμφάνιση της τεχνολογικής εποχής και καθόρισαν σε μεγάλο βαθμό την πορεία της ανθρώπινης ιστορίας τα τελευταία 300 χρόνια. Το άρθρο εξετάζει τον πρώτο, δεύτερο και τρίτο νόμο της θερμοδυναμικής και την εφαρμογή τους στην πράξη.
Τι είναι η θερμοδυναμική;
Πριν διατυπώσουμε τους νόμους της θερμοδυναμικής, ας καταλάβουμε τι κάνει αυτό το τμήμα της φυσικής.
Η λέξη «θερμοδυναμική» είναι ελληνικής προέλευσης και σημαίνει «κίνηση λόγω θερμότητας». Δηλαδή, αυτός ο κλάδος της φυσικής ασχολείται με τη μελέτη οποιωνδήποτε διεργασιών, ως αποτέλεσμα των οποίων η θερμική ενέργεια μετατρέπεται σε μηχανική κίνηση και αντίστροφα.
Οι βασικοί νόμοι της θερμοδυναμικής διατυπώθηκαν στα μέσα του 19ου αιώνα. Η επιστήμη της "κίνησης και θερμότητας" εξετάζει τη συμπεριφορά ολόκληρου του συστήματος στο σύνολό του, μελετώντας την αλλαγή στις μακροσκοπικές παραμέτρους του - θερμοκρασία, πίεση και όγκο, και χωρίς να δίνει προσοχή στη μικροσκοπική του δομή. Επιπλέον, το πρώτο από αυτά παίζει θεμελιώδη ρόλο στη διαμόρφωση των νόμωνη θερμοδυναμική στη φυσική. Είναι περίεργο να σημειωθεί ότι προέρχονται αποκλειστικά από πειραματικές παρατηρήσεις.
Η έννοια ενός θερμοδυναμικού συστήματος

Σημαίνει οποιαδήποτε ομάδα ατόμων, μορίων ή άλλων στοιχείων που θεωρούνται ως σύνολο. Και οι τρεις νόμοι διατυπώνονται για το λεγόμενο θερμοδυναμικό σύστημα. Παραδείγματα είναι: η ατμόσφαιρα της Γης, οποιοσδήποτε ζωντανός οργανισμός, το μείγμα αερίων σε μια μηχανή εσωτερικής καύσης κ.λπ.
Όλα τα συστήματα στη θερμοδυναμική ανήκουν σε έναν από τους τρεις τύπους:
- Άνοιγμα. Ανταλλάσσουν θερμότητα και ύλη με το περιβάλλον. Για παράδειγμα, εάν το φαγητό μαγειρεύεται σε μια κατσαρόλα σε ανοιχτή φωτιά, τότε αυτό είναι ένα ζωντανό παράδειγμα ανοιχτού συστήματος, αφού η κατσαρόλα λαμβάνει ενέργεια από το εξωτερικό περιβάλλον (φωτιά), ενώ η ίδια εκπέμπει ενέργεια με τη μορφή θερμότητας, και το νερό εξατμίζεται επίσης από αυτό (μεταβολισμός).
- Κλειστό. Σε τέτοια συστήματα δεν υπάρχει ανταλλαγή ύλης με το περιβάλλον, αν και λαμβάνει χώρα η ανταλλαγή ενέργειας. Επιστρέφοντας στην προηγούμενη περίπτωση: αν καλύψετε τον βραστήρα με ένα καπάκι, μπορείτε να πάρετε ένα κλειστό σύστημα.
- Απομονωμένο. Αυτό είναι ένα είδος θερμοδυναμικών συστημάτων που δεν ανταλλάσσουν ύλη ή ενέργεια με τον περιβάλλοντα χώρο. Ένα παράδειγμα θα ήταν ένα θερμός που περιέχει ζεστό τσάι.
Θερμοδυναμική θερμοκρασία

Αυτή η έννοια σημαίνει την κινητική ενέργεια των σωματιδίων που σχηματίζουν τα γύρω σώματα, η οποία αντανακλά την ταχύτητατυχαία κίνηση των σωματιδίων. Όσο μεγαλύτερο είναι, τόσο υψηλότερη είναι η θερμοκρασία. Αντίστοιχα, μειώνοντας την κινητική ενέργεια του συστήματος, το ψύχουμε.
Αυτή η έννοια σημαίνει την κινητική ενέργεια των σωματιδίων που σχηματίζουν τα γύρω σώματα, η οποία αντανακλά την ταχύτητα της χαοτικής κίνησης των σωματιδίων. Όσο μεγαλύτερο είναι, τόσο υψηλότερη είναι η θερμοκρασία. Αντίστοιχα, μειώνοντας την κινητική ενέργεια του συστήματος, το ψύχουμε.
Η θερμοδυναμική θερμοκρασία εκφράζεται σε SI (Διεθνές Σύστημα Μονάδων) σε Kelvin (προς τιμή του Βρετανού επιστήμονα William Kelvin, ο οποίος πρότεινε πρώτος αυτήν την κλίμακα). Η κατανόηση του πρώτου, του δεύτερου και του τρίτου νόμου της θερμοδυναμικής είναι αδύνατη χωρίς ορισμό της θερμοκρασίας.
Μια διαίρεση ενός βαθμού στην κλίμακα Kelvin αντιστοιχεί επίσης σε έναν βαθμό Κελσίου. Η μετατροπή μεταξύ αυτών των μονάδων πραγματοποιείται σύμφωνα με τον τύπο: TK =TC + 273, 15, όπου TK και TC - θερμοκρασίες σε Κέλβιν και βαθμούς Κελσίου αντίστοιχα.
Η ιδιαιτερότητα της κλίμακας Kelvin είναι ότι δεν έχει αρνητικές τιμές. Το μηδέν σε αυτό (TC=-273, 15 oC) αντιστοιχεί στην κατάσταση όταν η θερμική κίνηση των σωματιδίων του συστήματος είναι εντελώς απούσα, φαίνεται να είναι "παγωμένα".
Διατήρηση της ενέργειας και ο 1ος νόμος της θερμοδυναμικής

Το 1824, ο Nicolas Léonard Sadi Carnot, Γάλλος μηχανικός και φυσικός, έκανε μια τολμηρή πρόταση που όχι μόνο οδήγησε στην ανάπτυξη της φυσικής, αλλά έγινε επίσης ένα σημαντικό βήμα στη βελτίωση της τεχνολογίας. Τουμπορεί να διατυπωθεί ως εξής: "Η ενέργεια δεν μπορεί να δημιουργηθεί ή να καταστραφεί, μπορεί μόνο να μεταφερθεί από τη μια κατάσταση στην άλλη."
Στην πραγματικότητα, η φράση του Sadi Carnot υποθέτει τον νόμο της διατήρησης της ενέργειας, ο οποίος αποτέλεσε τη βάση του 1ου νόμου της θερμοδυναμικής: «Όποτε ένα σύστημα λαμβάνει ενέργεια από το εξωτερικό, τη μετατρέπει σε άλλες μορφές, η κύρια τα οποία είναι θερμικά και μηχανικά."
Ο μαθηματικός τύπος για τον 1ο νόμο γράφεται ως εξής:
Q=ΔU + A, εδώ Q είναι η ποσότητα θερμότητας που μεταφέρεται από το περιβάλλον στο σύστημα, ΔU είναι η αλλαγή στην εσωτερική ενέργεια αυτού του συστήματος, Α είναι η τέλεια μηχανική εργασία.
Αδιαβατικές διεργασίες
Ένα καλό παράδειγμα αυτών είναι η κίνηση των αέριων μαζών κατά μήκος των βουνοπλαγιών. Τέτοιες μάζες είναι τεράστιες (χιλιόμετρα ή περισσότερο) και ο αέρας είναι ένας εξαιρετικός μονωτήρας θερμότητας. Οι σημειωμένες ιδιότητες μας επιτρέπουν να θεωρούμε αδιαβατικές οποιεσδήποτε διεργασίες με μάζες αέρα που συμβαίνουν σε σύντομο χρονικό διάστημα. Όταν ο αέρας ανεβαίνει σε μια πλαγιά βουνού, η πίεσή του πέφτει, διαστέλλεται, δηλαδή εκτελεί μηχανικό έργο και, ως αποτέλεσμα, ψύχεται. Αντίθετα, η προς τα κάτω κίνηση της αέριας μάζας συνοδεύεται από αύξηση της πίεσης σε αυτήν, συμπιέζεται και, λόγω αυτού, θερμαίνεται πολύ.
Η εφαρμογή του νόμου της θερμοδυναμικής, που συζητήθηκε στην προηγούμενη υπότιτλο, αποδεικνύεται πιο εύκολα χρησιμοποιώντας το παράδειγμα μιας αδιαβατικής διαδικασίας.
Σύμφωνα με τον ορισμό, ως αποτέλεσμα αυτού δεν υπάρχει ανταλλαγή ενέργειας μεπεριβάλλον, δηλαδή στην παραπάνω εξίσωση Q=0. Αυτό οδηγεί στην ακόλουθη έκφραση: ΔU=-A. Το σύμβολο μείον εδώ σημαίνει ότι το σύστημα εκτελεί μηχανικό έργο μειώνοντας τη δική του εσωτερική ενέργεια. Θα πρέπει να υπενθυμίσουμε ότι η εσωτερική ενέργεια εξαρτάται άμεσα από τη θερμοκρασία του συστήματος.
Κατεύθυνση θερμικών διεργασιών
Αυτό το τεύχος ασχολείται με τον 2ο νόμο της θερμοδυναμικής. Σίγουρα όλοι παρατήρησαν ότι αν φέρετε σε επαφή δύο αντικείμενα με διαφορετικές θερμοκρασίες, τότε το κρύο θα ζεσταίνεται πάντα και το ζεστό θα κρυώνει. Σημειώστε ότι η αντίστροφη διαδικασία μπορεί να συμβεί στο πλαίσιο του πρώτου νόμου της θερμοδυναμικής, αλλά δεν εφαρμόζεται ποτέ στην πράξη.
Ο λόγος για το μη αναστρέψιμο αυτής της διαδικασίας (και όλων των γνωστών διεργασιών στο Σύμπαν) είναι η μετάβαση του συστήματος σε μια πιο πιθανή κατάσταση. Στο εξεταζόμενο παράδειγμα με την επαφή δύο σωμάτων διαφορετικών θερμοκρασιών, η πιο πιθανή κατάσταση θα είναι αυτή στην οποία όλα τα σωματίδια του συστήματος θα έχουν την ίδια κινητική ενέργεια.
Ο δεύτερος νόμος της θερμοδυναμικής μπορεί να διατυπωθεί ως εξής: «Η θερμότητα δεν μπορεί ποτέ να μεταφερθεί αυθόρμητα από ένα ψυχρό σώμα σε ένα ζεστό». Αν εισαγάγουμε την έννοια της εντροπίας ως μέτρο της αταξίας, τότε μπορεί να αναπαρασταθεί ως εξής: "Οποιαδήποτε θερμοδυναμική διεργασία προχωρά με αύξηση της εντροπίας".
Θερμομηχανή

Αυτός ο όρος νοείται ως ένα σύστημα που, λόγω της παροχής εξωτερικής ενέργειας σε αυτό, μπορεί να εκτελέσει μηχανικές εργασίες. ΠρώταΟι θερμικές μηχανές ήταν ατμομηχανές και εφευρέθηκαν στα τέλη του 17ου αιώνα.
Ο δεύτερος νόμος της θερμοδυναμικής παίζει καθοριστικό ρόλο στον καθορισμό της αποτελεσματικότητάς τους. Ο Sadi Carnot διαπίστωσε επίσης ότι η μέγιστη απόδοση αυτής της συσκευής είναι: Απόδοση=(T2 - T1)/T2, εδώ T2 και T1 είναι οι θερμοκρασίες του θερμαντήρα και του ψυγείου. Η μηχανική εργασία μπορεί να γίνει μόνο όταν υπάρχει ροή θερμότητας από ένα θερμό σώμα σε ένα ψυχρό και αυτή η ροή δεν μπορεί να μετατραπεί 100% σε χρήσιμη ενέργεια.
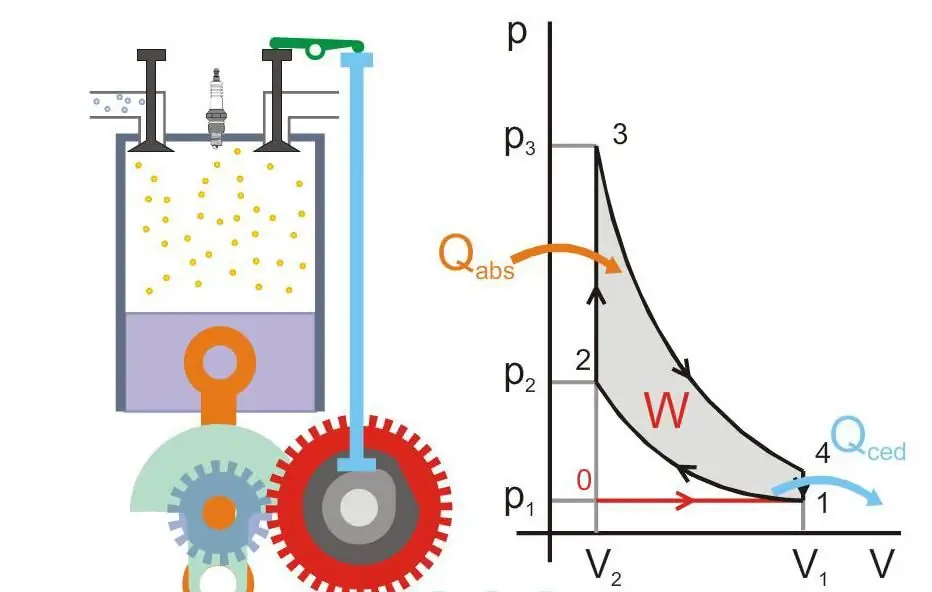
Το παρακάτω σχήμα δείχνει την αρχή λειτουργίας μιας θερμικής μηχανής (Qabs - θερμότητα που μεταφέρεται στο μηχάνημα, Qced - απώλεια θερμότητας, W - χρήσιμη εργασία, P και V - πίεση και όγκος αερίου στο έμβολο).
Το απόλυτο μηδέν και το αξίωμα του Nernst
Τέλος, ας προχωρήσουμε στην εξέταση του τρίτου νόμου της θερμοδυναμικής. Ονομάζεται επίσης αξίωμα Nernst (το όνομα του Γερμανού φυσικού που το διατύπωσε για πρώτη φορά στις αρχές του 20ου αιώνα). Ο νόμος λέει: «Το απόλυτο μηδέν δεν μπορεί να επιτευχθεί με έναν πεπερασμένο αριθμό διαδικασιών». Δηλαδή, είναι αδύνατο με οποιονδήποτε τρόπο να «παγώσουν» εντελώς τα μόρια και τα άτομα μιας ουσίας. Ο λόγος για αυτό είναι η συνεχής υπάρχουσα ανταλλαγή θερμότητας με το περιβάλλον.

Ένα χρήσιμο συμπέρασμα που συνάγεται από τον τρίτο νόμο της θερμοδυναμικής είναι ότι η εντροπία μειώνεται καθώς κάποιος κινείται προς το απόλυτο μηδέν. Αυτό σημαίνει ότι το σύστημα τείνει να οργανωθεί. Αυτό το γεγονός μπορείχρησιμοποιήστε, για παράδειγμα, για να μεταφέρετε παραμαγνήτες σε σιδηρομαγνητική κατάσταση όταν ψύχονται.
Είναι ενδιαφέρον να σημειωθεί ότι η χαμηλότερη θερμοκρασία που έχει επιτευχθεί μέχρι στιγμής είναι 5·10−10 K (2003, εργαστήριο MIT, ΗΠΑ).






