Η κβαντική μηχανική ασχολείται με τα αντικείμενα του μικροκόσμου, με τα πιο στοιχειώδη συστατικά της ύλης. Η συμπεριφορά τους καθορίζεται από πιθανολογικούς νόμους, που εκδηλώνονται με τη μορφή της δυαδικότητας σωματικού κυμάτων - δυϊσμού. Επιπλέον, σημαντικό ρόλο στην περιγραφή τους παίζει μια τόσο θεμελιώδης ποσότητα όπως η φυσική δράση. Η φυσική μονάδα που ορίζει την κλίμακα κβαντοποίησης για αυτήν την ποσότητα είναι η σταθερά του Planck. Διέπει επίσης μια από τις θεμελιώδεις φυσικές αρχές - τη σχέση αβεβαιότητας. Αυτή η φαινομενικά απλή ανισότητα αντανακλά το φυσικό όριο στο οποίο η φύση μπορεί να απαντήσει σε μερικές από τις ερωτήσεις μας ταυτόχρονα.
Προϋποθέσεις για την εξαγωγή της σχέσης αβεβαιότητας
Η πιθανολογική ερμηνεία της κυματικής φύσης των σωματιδίων, που εισήχθη στην επιστήμη από τον M. Born το 1926, έδειξε ξεκάθαρα ότι οι κλασικές ιδέες για την κίνηση δεν μπορούν να εφαρμοστούν σε φαινόμενα στις κλίμακες ατόμων και ηλεκτρονίων. Ταυτόχρονα, ορισμένες πτυχές του matrixη μηχανική, που δημιούργησε ο W. Heisenberg ως μέθοδος μαθηματικής περιγραφής κβαντικών αντικειμένων, απαιτούσε την αποσαφήνιση της φυσικής τους σημασίας. Άρα, αυτή η μέθοδος λειτουργεί με διακριτά σύνολα παρατηρήσιμων στοιχείων, που αναπαρίστανται ως ειδικοί πίνακες - πίνακες και ο πολλαπλασιασμός τους έχει την ιδιότητα της μη-ανταλλαγής, με άλλα λόγια, A×B ≠ B×A.

Όπως εφαρμόζεται στον κόσμο των μικροσωματιδίων, αυτό μπορεί να ερμηνευτεί ως εξής: το αποτέλεσμα των εργασιών για τη μέτρηση των παραμέτρων Α και Β εξαρτάται από τη σειρά με την οποία εκτελούνται. Επιπλέον, η ανισότητα σημαίνει ότι αυτές οι παράμετροι δεν μπορούν να μετρηθούν ταυτόχρονα. Ο Heisenberg ερεύνησε το ζήτημα της σχέσης μεταξύ μέτρησης και κατάστασης ενός μικροαντικειμένου, δημιουργώντας ένα σκεπτικό πείραμα για να επιτύχει το όριο ακρίβειας της ταυτόχρονης μέτρησης παραμέτρων σωματιδίων όπως η ορμή και η θέση (αυτές οι μεταβλητές ονομάζονται κανονικά συζευγμένες).
Διατύπωση της αρχής της αβεβαιότητας
Το αποτέλεσμα των προσπαθειών του Heisenberg ήταν το συμπέρασμα το 1927 του ακόλουθου περιορισμού σχετικά με την εφαρμογή των κλασικών εννοιών σε κβαντικά αντικείμενα: με την αύξηση της ακρίβειας στον προσδιορισμό της συντεταγμένης, η ακρίβεια με την οποία μπορεί να γίνει γνωστή η ορμή μειώνεται. Ισχύει και το αντίστροφο. Μαθηματικά, αυτός ο περιορισμός εκφράστηκε στη σχέση αβεβαιότητας: Δx∙Δp ≈ h. Εδώ x είναι η συντεταγμένη, p είναι η ορμή και h η σταθερά του Planck. Ο Χάιζενμπεργκ βελτίωσε αργότερα τη σχέση: Δx∙Δp ≧ h. Το γινόμενο των "δέλτα" - spreads στην τιμή της συντεταγμένης και της ορμής - που έχει τη διάσταση της δράσης δεν μπορεί να είναι μικρότερο από το "μικρότερομέρος» αυτής της ποσότητας είναι η σταθερά του Planck. Κατά κανόνα, η μειωμένη σταθερά Planck ħ=h/2π χρησιμοποιείται σε τύπους.
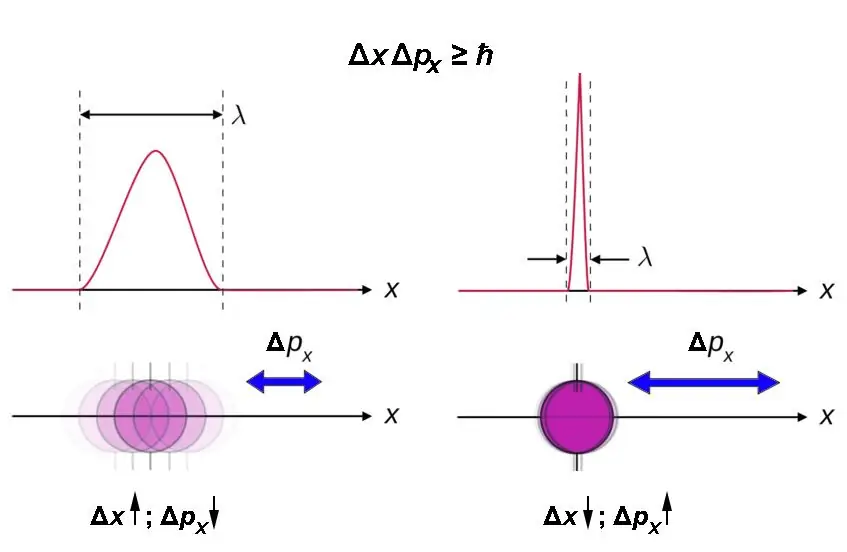
Η παραπάνω αναλογία γενικεύεται. Πρέπει να ληφθεί υπόψη ότι ισχύει μόνο για κάθε ζεύγος συντεταγμένων - συνιστώσας (προβολή) της ώθησης στον αντίστοιχο άξονα:
- Δx∙Δpx ≧ ħ.
- Δy∙Δpy ≧ ħ.
- Δz∙Δpz ≧ ħ.
Η σχέση αβεβαιότητας Heisenberg μπορεί να εκφραστεί εν συντομία ως εξής: όσο μικρότερη είναι η περιοχή του χώρου στην οποία κινείται ένα σωματίδιο, τόσο πιο αβέβαιη είναι η ορμή του.
Πείραμα σκέψης με μικροσκόπιο γάμμα
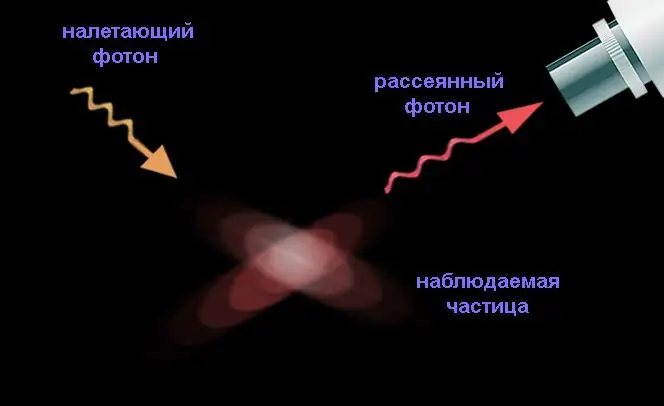
Σαν παράδειγμα της αρχής που ανακάλυψε, ο Heisenberg θεώρησε μια φανταστική συσκευή που σας επιτρέπει να μετρήσετε τη θέση και την ταχύτητα (και μέσω αυτής την ορμή) ενός ηλεκτρονίου αυθαίρετα με ακρίβεια, διασκορπίζοντας ένα φωτόνιο πάνω του: τελικά, οποιαδήποτε μέτρηση μειώνεται σε μια πράξη αλληλεπίδρασης σωματιδίων, χωρίς αυτό ένα σωματίδιο δεν είναι καθόλου ανιχνεύσιμο.
Για να αυξηθεί η ακρίβεια της μέτρησης των συντεταγμένων, χρειάζεται ένα φωτόνιο μικρότερου μήκους κύματος, που σημαίνει ότι θα έχει μεγάλη ορμή, σημαντικό μέρος της οποίας θα μεταφερθεί στο ηλεκτρόνιο κατά τη σκέδαση. Αυτό το μέρος δεν μπορεί να προσδιοριστεί, αφού το φωτόνιο σκεδάζεται στο σωματίδιο με τυχαίο τρόπο (παρά το γεγονός ότι η ορμή είναι διανυσματική ποσότητα). Εάν το φωτόνιο χαρακτηρίζεται από μικρή ορμή, τότε έχει μεγάλο μήκος κύματος, επομένως, η συντεταγμένη του ηλεκτρονίου θα μετρηθεί με σημαντικό σφάλμα.
Η θεμελιώδης φύση της σχέσης αβεβαιότητας
Στην κβαντομηχανική, η σταθερά του Planck, όπως σημειώθηκε παραπάνω, παίζει ιδιαίτερο ρόλο. Αυτή η θεμελιώδης σταθερά περιλαμβάνεται σε όλες σχεδόν τις εξισώσεις αυτού του κλάδου της φυσικής. Η παρουσία του στον τύπο του λόγου αβεβαιότητας του Heisenberg, πρώτον, δείχνει τον βαθμό στον οποίο εκδηλώνονται αυτές οι αβεβαιότητες και, δεύτερον, δείχνει ότι αυτό το φαινόμενο δεν σχετίζεται με την ατέλεια των μέσων και των μεθόδων μέτρησης, αλλά με τις ιδιότητες της ύλης. η ίδια και είναι καθολική.
Μπορεί να φαίνεται ότι στην πραγματικότητα το σωματίδιο εξακολουθεί να έχει συγκεκριμένες τιμές ταχύτητας και συντεταγμένων ταυτόχρονα, και η πράξη μέτρησης εισάγει αμετάκλητη παρεμβολή στην εγκατάστασή τους. Ωστόσο, δεν είναι. Η κίνηση ενός κβαντικού σωματιδίου σχετίζεται με τη διάδοση ενός κύματος, το πλάτος του οποίου (ακριβέστερα, το τετράγωνο της απόλυτης τιμής του) δείχνει την πιθανότητα να βρίσκεται σε ένα συγκεκριμένο σημείο. Αυτό σημαίνει ότι ένα κβαντικό αντικείμενο δεν έχει τροχιά με την κλασική έννοια. Μπορούμε να πούμε ότι έχει ένα σύνολο τροχιών και όλες, σύμφωνα με τις πιθανότητές τους, εκτελούνται κατά την κίνηση (αυτό επιβεβαιώνεται, για παράδειγμα, από πειράματα για παρεμβολή ηλεκτρονιακών κυμάτων).

Η απουσία κλασικής τροχιάς ισοδυναμεί με την απουσία τέτοιων καταστάσεων σε ένα σωματίδιο στο οποίο η ορμή και οι συντεταγμένες θα χαρακτηρίζονταν από ακριβείς τιμές ταυτόχρονα. Πράγματι, δεν έχει νόημα να μιλάμε για «το μήκοςκύμα σε κάποιο σημείο», και εφόσον η ορμή σχετίζεται με το μήκος κύματος με τη σχέση de Broglie p=h/λ, ένα σωματίδιο με συγκεκριμένη ορμή δεν έχει συγκεκριμένη συντεταγμένη. Αντίστοιχα, εάν το μικροαντικείμενο έχει μια ακριβή συντεταγμένη, η ορμή γίνεται εντελώς αόριστη.
Αβεβαιότητα και δράση σε μικρό και μακροοικονομικό κόσμο
Η φυσική δράση ενός σωματιδίου εκφράζεται ως προς τη φάση του κύματος πιθανότητας με τον συντελεστή ħ=h/2π. Κατά συνέπεια, η δράση, ως φάση που ελέγχει το πλάτος του κύματος, συνδέεται με όλες τις πιθανές τροχιές και η πιθανολογική αβεβαιότητα σε σχέση με τις παραμέτρους που σχηματίζουν την τροχιά είναι θεμελιωδώς μη αφαιρέσιμη.
Η δράση είναι ανάλογη της θέσης και της ορμής. Αυτή η τιμή μπορεί επίσης να αναπαρασταθεί ως η διαφορά μεταξύ της κινητικής και της δυναμικής ενέργειας, ενσωματωμένη με την πάροδο του χρόνου. Εν ολίγοις, η δράση είναι ένα μέτρο του τρόπου με τον οποίο η κίνηση ενός σωματιδίου αλλάζει με την πάροδο του χρόνου και εξαρτάται, εν μέρει, από τη μάζα του.
Εάν η δράση υπερβαίνει σημαντικά τη σταθερά του Planck, η πιο πιθανή είναι η τροχιά που καθορίζεται από ένα τέτοιο πλάτος πιθανότητας, το οποίο αντιστοιχεί στη μικρότερη ενέργεια. Η σχέση αβεβαιότητας Heisenberg εκφράζει εν συντομία το ίδιο πράγμα εάν τροποποιηθεί ώστε να ληφθεί υπόψη ότι η ορμή είναι ίση με το γινόμενο της μάζας m και της ταχύτητας v: Δx∙Δvx ≧ ħ/m. Γίνεται αμέσως σαφές ότι με την αύξηση της μάζας του αντικειμένου, οι αβεβαιότητες γίνονται όλο και λιγότερες, και όταν περιγράφουμε την κίνηση των μακροσκοπικών σωμάτων, η κλασική μηχανική είναι αρκετά εφαρμόσιμη.

Ενέργεια και χρόνος
Η αρχή της αβεβαιότητας ισχύει επίσης για άλλες συζευγμένες ποσότητες που αντιπροσωπεύουν τα δυναμικά χαρακτηριστικά των σωματιδίων. Αυτά, συγκεκριμένα, είναι η ενέργεια και ο χρόνος. Επίσης, όπως αναφέρθηκε ήδη, καθορίζουν τη δράση.
Η σχέση αβεβαιότητας ενέργειας-χρόνου έχει τη μορφή ΔE∙Δt ≧ ħ και δείχνει πώς σχετίζονται η ακρίβεια της τιμής ενέργειας των σωματιδίων ΔE και το χρονικό διάστημα Δt στο οποίο πρέπει να εκτιμηθεί αυτή η ενέργεια. Επομένως, δεν μπορεί να υποστηριχθεί ότι ένα σωματίδιο μπορεί να έχει μια αυστηρά καθορισμένη ενέργεια σε κάποια συγκεκριμένη χρονική στιγμή. Όσο μικρότερη είναι η περίοδος Δt που θα εξετάσουμε, τόσο μεγαλύτερη θα είναι η διακύμανση της ενέργειας των σωματιδίων.
Ένα ηλεκτρόνιο σε ένα άτομο
Είναι δυνατό να υπολογιστεί, χρησιμοποιώντας τη σχέση αβεβαιότητας, το πλάτος του ενεργειακού επιπέδου, για παράδειγμα, ενός ατόμου υδρογόνου, δηλαδή την εξάπλωση των τιμών ενέργειας των ηλεκτρονίων σε αυτό. Στη θεμελιώδη κατάσταση, όταν το ηλεκτρόνιο βρίσκεται στο χαμηλότερο επίπεδο, το άτομο μπορεί να υπάρχει επ' αόριστον, με άλλα λόγια, Δt→∞ και, κατά συνέπεια, η ΔE παίρνει μηδενική τιμή. Στη διεγερμένη κατάσταση, το άτομο παραμένει μόνο για κάποιο πεπερασμένο χρόνο της τάξης των 10-8 s, που σημαίνει ότι έχει ενεργειακή αβεβαιότητα ΔE=ħ/Δt ≈ (1, 05 ∙10- 34 J∙s)/(10-8 s) ≈ 10-26 J, που είναι περίπου 7∙10 -8 eV. Συνέπεια αυτού είναι η αβεβαιότητα της συχνότητας του εκπεμπόμενου φωτονίου Δν=ΔE/ħ, η οποία εκδηλώνεται ως παρουσία κάποιων φασματικών γραμμώνθαμπάδα και το λεγόμενο φυσικό πλάτος.
Μπορούμε επίσης με απλούς υπολογισμούς, χρησιμοποιώντας τη σχέση αβεβαιότητας, να υπολογίσουμε τόσο το πλάτος της διασποράς των συντεταγμένων ενός ηλεκτρονίου που διέρχεται από μια οπή σε ένα εμπόδιο, όσο και τις ελάχιστες διαστάσεις ενός ατόμου και την τιμή του το χαμηλότερο ενεργειακό του επίπεδο. Η αναλογία που προκύπτει από τον W. Heisenberg βοηθά στην επίλυση πολλών προβλημάτων.

Φιλοσοφική κατανόηση της αρχής της αβεβαιότητας
Η παρουσία αβεβαιοτήτων συχνά ερμηνεύεται λανθασμένα ως απόδειξη πλήρους χάους που υποτίθεται ότι κυριαρχεί στον μικρόκοσμο. Αλλά η αναλογία τους μας λέει κάτι εντελώς διαφορετικό: μιλώντας πάντα σε ζευγάρια, φαίνεται να επιβάλλουν έναν εντελώς φυσικό περιορισμό ο ένας στον άλλο.
Η αναλογία, η οποία συνδέει αμοιβαία τις αβεβαιότητες των δυναμικών παραμέτρων, είναι μια φυσική συνέπεια της φύσης της ύλης διπλού - σωματικού κύματος. Ως εκ τούτου, χρησίμευσε ως βάση για την ιδέα που διατύπωσε ο N. Bohr με στόχο την ερμηνεία του φορμαλισμού της κβαντικής μηχανικής - της αρχής της συμπληρωματικότητας. Μπορούμε να λάβουμε όλες τις πληροφορίες για τη συμπεριφορά των κβαντικών αντικειμένων μόνο μέσω μακροσκοπικών οργάνων και αναγκαστικά αναγκαζόμαστε να χρησιμοποιήσουμε την εννοιολογική συσκευή που αναπτύχθηκε στο πλαίσιο της κλασικής φυσικής. Έτσι, έχουμε την ευκαιρία να διερευνήσουμε είτε τις κυματικές ιδιότητες τέτοιων αντικειμένων, είτε τις σωματιδιακές, αλλά ποτέ και τα δύο ταυτόχρονα. Δυνάμει αυτής της περίστασης, πρέπει να τα θεωρούμε όχι ως αντιφατικά, αλλά ως συμπληρωματικά μεταξύ τους. Ένας απλός τύπος για τη σχέση αβεβαιότηταςμας υποδεικνύει τα όρια κοντά στα οποία είναι απαραίτητο να συμπεριλάβουμε την αρχή της συμπληρωματικότητας για μια επαρκή περιγραφή της κβαντομηχανικής πραγματικότητας.






