Ένα από τα σημαντικά ερωτήματα στη μελέτη των θερμοδυναμικών συστημάτων στη φυσική είναι το ερώτημα εάν αυτό το σύστημα μπορεί να εκτελέσει κάποια χρήσιμη εργασία. Στενά συνδεδεμένη με την έννοια της εργασίας είναι η έννοια της εσωτερικής ενέργειας. Σε αυτό το άρθρο, θα εξετάσουμε ποια είναι η εσωτερική ενέργεια ενός ιδανικού αερίου και θα δώσουμε τύπους για τον υπολογισμό της.
Ιδανικό αέριο
Σχετικά με το αέριο, ως κατάσταση συσσωμάτωσης, το οποίο δεν έχει καμία ελαστική δύναμη κάτω από εξωτερική επίδραση πάνω του και, ως εκ τούτου, δεν διατηρεί όγκο και σχήμα, γνωρίζει κάθε μαθητής. Η έννοια του ιδανικού αερίου για πολλούς παραμένει ακατανόητη και ασαφής. Ας το εξηγήσουμε.
Ιδανικό αέριο είναι κάθε αέριο που ικανοποιεί τις ακόλουθες δύο σημαντικές προϋποθέσεις:
- Τα σωματίδια που το αποτελούν δεν έχουν μέγεθος. Έχουν ένα μέγεθος, αλλά είναι τόσο μικρό σε σύγκριση με τις μεταξύ τους αποστάσεις που μπορεί να αγνοηθεί σε όλους τους μαθηματικούς υπολογισμούς.
- Τα σωματίδια δεν αλληλεπιδρούν μεταξύ τους χρησιμοποιώντας δυνάμεις ή δυνάμεις van der Waalsάλλη φύση. Στην πραγματικότητα, σε όλα τα πραγματικά αέρια, υπάρχει μια τέτοια αλληλεπίδραση, αλλά η ενέργειά της είναι αμελητέα σε σύγκριση με τη μέση ενέργεια των κινητικών σωματιδίων.
Οι περιγραφόμενες συνθήκες ικανοποιούνται από όλα σχεδόν τα πραγματικά αέρια, των οποίων οι θερμοκρασίες είναι πάνω από 300 K και οι πιέσεις δεν υπερβαίνουν τη μία ατμόσφαιρα. Για πολύ υψηλές πιέσεις και χαμηλές θερμοκρασίες παρατηρείται η απόκλιση των αερίων από την ιδανική συμπεριφορά. Σε αυτή την περίπτωση, μιλάμε για πραγματικά αέρια. Περιγράφονται από την εξίσωση van der Waals.
Η έννοια της εσωτερικής ενέργειας ενός ιδανικού αερίου
Σύμφωνα με τον ορισμό, η εσωτερική ενέργεια ενός συστήματος είναι το άθροισμα των κινητικών και δυνητικών ενεργειών που περιέχονται σε αυτό το σύστημα. Εάν αυτή η ιδέα εφαρμόζεται σε ένα ιδανικό αέριο, τότε το πιθανό συστατικό θα πρέπει να απορριφθεί. Πράγματι, δεδομένου ότι τα σωματίδια ενός ιδανικού αερίου δεν αλληλεπιδρούν μεταξύ τους, μπορούν να θεωρηθούν ότι κινούνται ελεύθερα στο απόλυτο κενό. Για να εξαχθεί ένα σωματίδιο από το υπό μελέτη σύστημα, δεν είναι απαραίτητο να γίνει εργασία ενάντια στις εσωτερικές δυνάμεις της αλληλεπίδρασης, καθώς αυτές οι δυνάμεις δεν υπάρχουν.
Έτσι, η εσωτερική ενέργεια ενός ιδανικού αερίου συμπίπτει πάντα με την κινητική του ενέργεια. Το τελευταίο, με τη σειρά του, καθορίζεται μοναδικά από τη μοριακή μάζα των σωματιδίων του συστήματος, τον αριθμό τους, καθώς και τη μέση ταχύτητα μεταφορικής και περιστροφικής κίνησης. Η ταχύτητα κίνησης εξαρτάται από τη θερμοκρασία. Η αύξηση της θερμοκρασίας οδηγεί σε αύξηση της εσωτερικής ενέργειας και αντίστροφα.
Φόρμουλα γιαεσωτερική ενέργεια
Δηλώστε την εσωτερική ενέργεια ενός ιδανικού συστήματος αερίου με το γράμμα U. Σύμφωνα με τη θερμοδυναμική, ορίζεται ως η διαφορά μεταξύ της ενθαλπίας H του συστήματος και του γινόμενου πίεσης και όγκου, δηλαδή:
U=H - pV.
Στην παραπάνω παράγραφο, ανακαλύψαμε ότι η τιμή του U αντιστοιχεί στη συνολική κινητική ενέργεια Ek όλων των σωματιδίων αερίου:
U=Ek.
Από τη στατιστική μηχανική, στο πλαίσιο της μοριακής κινητικής θεωρίας (MKT) ενός ιδανικού αερίου, προκύπτει ότι η μέση κινητική ενέργεια ενός σωματιδίου Ek1 είναι ίση με το ακόλουθη τιμή:
Ek1=z/2kBT.
Εδώ kB και T - Σταθερά και θερμοκρασία Boltzmann, z - αριθμός βαθμών ελευθερίας. Η συνολική κινητική ενέργεια του συστήματος Ek μπορεί να ληφθεί πολλαπλασιάζοντας το Ek1 με τον αριθμό των σωματιδίων N στο σύστημα:
Ek=NEk1=z/2NkBT.
Έτσι, έχουμε τον τύπο για την εσωτερική ενέργεια ενός ιδανικού αερίου, γραμμένο σε γενική μορφή ως προς την απόλυτη θερμοκρασία και τον αριθμό των σωματιδίων σε ένα κλειστό σύστημα:
U=z/2NkBT.
Μονατομικό και πολυατομικό αέριο
Ο τύπος για το U που γράφτηκε στην προηγούμενη παράγραφο του άρθρου δεν είναι βολικός για την πρακτική χρήση του, καθώς είναι δύσκολο να προσδιοριστεί ο αριθμός των σωματιδίων N. Ωστόσο, αν λάβουμε υπόψη τον ορισμό της ποσότητας της ουσίας n, τότε αυτή η έκφραση μπορεί να ξαναγραφτεί με μια πιο βολική μορφή:
n=N/NA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
Ο αριθμός των βαθμών ελευθερίας z εξαρτάται από τη γεωμετρία των σωματιδίων που αποτελούν το αέριο. Έτσι, για ένα μονοατομικό αέριο, z=3, αφού ένα άτομο μπορεί να κινηθεί ανεξάρτητα μόνο σε τρεις κατευθύνσεις του χώρου. Εάν το αέριο είναι διατομικό, τότε z=5, αφού προστίθενται δύο ακόμη περιστροφικοί βαθμοί ελευθερίας στους τρεις μεταφορικούς βαθμούς ελευθερίας. Τέλος, για οποιοδήποτε άλλο πολυατομικό αέριο, z=6 (3 μεταφορικοί και 3 περιστροφικοί βαθμοί ελευθερίας). Έχοντας αυτό υπόψη, μπορούμε να γράψουμε με την ακόλουθη μορφή τους τύπους για την εσωτερική ενέργεια ενός ιδανικού αερίου μονατομικού, διατομικού και πολυατομικού:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Παράδειγμα εργασίας για τον προσδιορισμό της εσωτερικής ενέργειας
Ένας κύλινδρος 100 λίτρων περιέχει καθαρό υδρογόνο σε πίεση 3 ατμοσφαιρών. Υποθέτοντας ότι το υδρογόνο είναι ιδανικό αέριο υπό δεδομένες συνθήκες, είναι απαραίτητο να προσδιοριστεί ποια είναι η εσωτερική του ενέργεια.

Οι παραπάνω τύποι για το U περιέχουν την ποσότητα της ουσίας και τη θερμοκρασία του αερίου. Στην κατάσταση του προβλήματος δεν λέγεται απολύτως τίποτα για αυτές τις ποσότητες. Για να λυθεί το πρόβλημα, είναι απαραίτητο να υπενθυμίσουμε την καθολική εξίσωση Clapeyron-Mendeleev. Έχει την εμφάνιση που φαίνεται στο σχήμα.
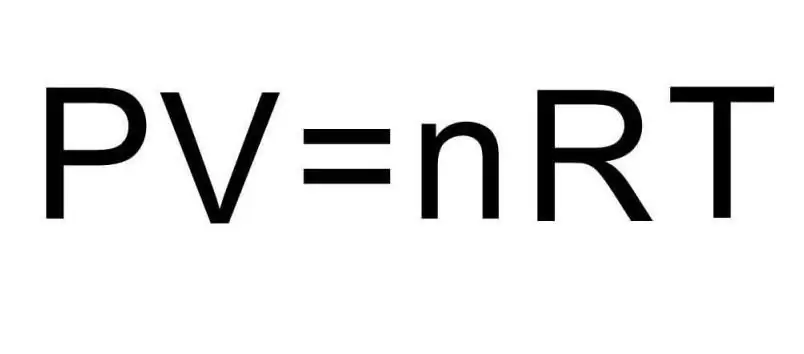
Δεδομένου ότι το υδρογόνο H2 είναι ένα διατομικό μόριο, ο τύπος για την εσωτερική ενέργεια είναι:
UH2=5/2nRT.
Συγκρίνοντας και τις δύο εκφράσεις, καταλήγουμε στον τελικό τύπο για την επίλυση του προβλήματος:
UH2=5/2PV.
Απομένει να μετατρέψουμε τις μονάδες πίεσης και όγκου από τη συνθήκη στο σύστημα μονάδων SI, να αντικαταστήσουμε τις αντίστοιχες τιμές στον τύπο για το UH2 και να πάρουμε το απάντηση: UH2 ≈ 76 kJ.






