Η αγωγομετρική μέθοδος ανάλυσης είναι η μέτρηση της ηλεκτρολυτικής αγωγιμότητας για την παρακολούθηση της προόδου μιας χημικής αντίδρασης. Αυτή η επιστήμη εφαρμόζεται ευρέως στην αναλυτική χημεία, όπου η τιτλοδότηση είναι μια τυπική μέθοδος λειτουργίας. Τι είναι η αγωγιμότητα; Στην κοινή πρακτική στην αναλυτική χημεία, ο όρος χρησιμοποιείται ως συνώνυμο της ογκομέτρησης, ενώ χρησιμοποιείται επίσης για να περιγράψει εφαρμογές μη τιτλοδότησης. Ποιο είναι το όφελος από τη χρήση αυτής της μεθόδου ανάλυσης; Συχνά χρησιμοποιείται για τον προσδιορισμό της συνολικής αγωγιμότητας ενός διαλύματος ή για την ανάλυση του τελικού σημείου μιας τιτλοδότησης που περιλαμβάνει ιόντα.
Ιστορία
Οι αγώγιμες μετρήσεις ξεκίνησαν ήδη από τον 18ο αιώνα, όταν ο Andreas Baumgartner παρατήρησε ότι το αλάτι και τα μεταλλικά νερά από το Bad Gastein στοΗ Αυστρία διεξάγει ηλεκτρισμό. Έτσι, η χρήση αυτής της μεθόδου για τον προσδιορισμό της καθαρότητας του νερού, η οποία χρησιμοποιείται συχνά σήμερα για τη δοκιμή της αποτελεσματικότητας των συστημάτων καθαρισμού του νερού, ξεκίνησε το 1776. Έτσι ξεκίνησε η ιστορία της αγωγομετρικής μεθόδου ανάλυσης.
Friedrich Kohlrausch συνέχισε την ανάπτυξη αυτής της επιστήμης στη δεκαετία του 1860, όταν εφάρμοσε εναλλασσόμενο ρεύμα σε νερό, οξέα και άλλα διαλύματα. Εκείνη την εποχή, ο Willis Whitney, ο οποίος μελετούσε τις αλληλεπιδράσεις των συμπλεγμάτων θειικού οξέος και θειικού χρωμίου, βρήκε το πρώτο αγωγομετρικό τελικό σημείο. Αυτά τα ευρήματα κορυφώθηκαν με την ποτενσιομετρική τιτλοδότηση και το πρώτο όργανο για ογκομετρική ανάλυση από τον Robert Behrend το 1883 στην τιτλοδότηση χλωριδίου και βρωμιδίου HgNO3. Έτσι, η σύγχρονη αγωγομετρική μέθοδος ανάλυσης βασίζεται στον Behrend.
Αυτή η εξέλιξη κατέστησε δυνατή τη δοκιμή της διαλυτότητας των αλάτων και της συγκέντρωσης των ιόντων υδρογόνου, καθώς και των τιτλοδοτήσεων οξέος-βάσης και οξειδοαναγωγής. Η αγωγομετρική μέθοδος ανάλυσης βελτιώθηκε με την ανάπτυξη του ηλεκτροδίου γυαλιού, που ξεκίνησε το 1909.
Τιτλοδότηση
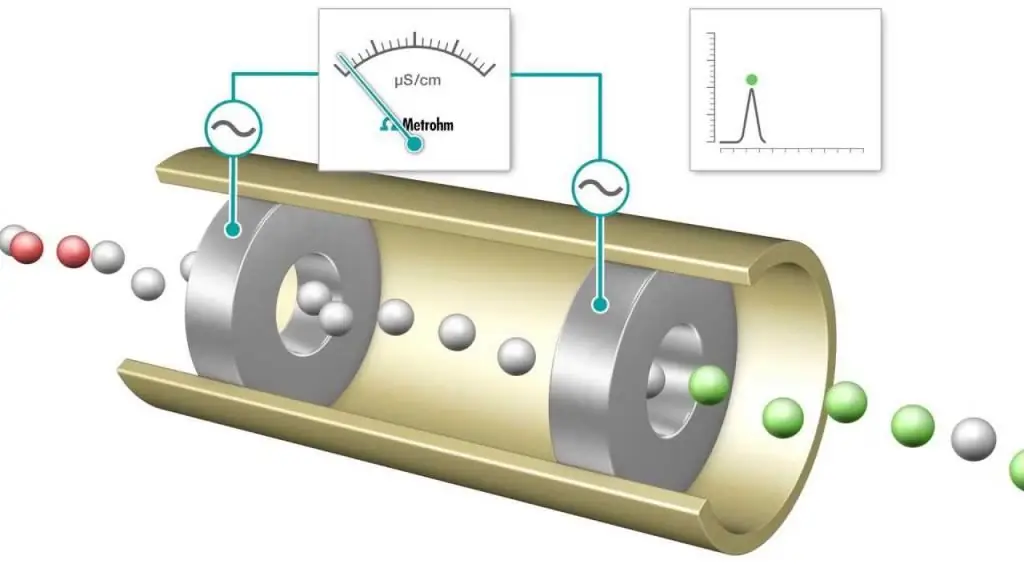
Αγωγομετρική τιτλοδότηση είναι μια μέτρηση στην οποία η ηλεκτρολυτική αγωγιμότητα ενός μείγματος αντίδρασης παρακολουθείται συνεχώς με την προσθήκη ενός αντιδραστηρίου. Το σημείο ισοδυναμίας είναι το σημείο στο οποίο η αγωγιμότητα αλλάζει ξαφνικά. Μια αξιοσημείωτη αύξηση ή μείωση της αγωγιμότητας σχετίζεται με μια αλλαγή στη συγκέντρωση των δύο πιο αγώγιμων ιόντων, των ιόντων υδρογόνου και υδροξειδίου. Αυτή η μέθοδοςμπορεί να χρησιμοποιηθεί για την τιτλοδότηση έγχρωμων διαλυμάτων ή ομοιογενών εναιωρημάτων (π.χ. εναιώρημα ξυλοπολτού) που δεν μπορεί να χρησιμοποιηθεί με συμβατικούς δείκτες.
Οξινοβασικές και οξειδοαναγωγικές τιτλοδοτήσεις εκτελούνται συχνά, οι οποίες χρησιμοποιούν κοινούς δείκτες για τον προσδιορισμό του τελικού σημείου, όπως μεθυλοπορτοκάλι, φαινολοφθαλεΐνη για ογκομέτρηση οξέος-βάσης και διαλύματα αμύλου για μια διεργασία οξειδοαναγωγής ιωδομετρικού τύπου. Ωστόσο, οι μετρήσεις ηλεκτρικής αγωγιμότητας μπορούν επίσης να χρησιμοποιηθούν ως εργαλείο για τον προσδιορισμό του τελικού σημείου, για παράδειγμα κατά την παρατήρηση ενός διαλύματος HCl με ισχυρή βάση NaOH.
Εξουδετέρωση πρωτονίων
Καθώς προχωρά η τιτλοδότηση, τα πρωτόνια εξουδετερώνονται για να σχηματίσουν NaOH σχηματίζοντας νερό. Για κάθε ποσότητα NaOH που προστίθεται, αφαιρείται ένας ισοδύναμος αριθμός ιόντων υδρογόνου. Στην πραγματικότητα, το κινητό κατιόν Η+ αντικαθίσταται από το λιγότερο κινητό ιόν Na+ και η αγωγιμότητα του τιτλοδοτημένου διαλύματος, καθώς και η μετρούμενη αγωγιμότητα των κυττάρων, μειώνονται. Αυτό συνεχίζεται έως ότου επιτευχθεί ένα σημείο ισοδυναμίας στο οποίο μπορεί να ληφθεί ένα διάλυμα χλωριούχου νατρίου NaCl. Εάν προστεθεί περισσότερη βάση, υπάρχει αύξηση καθώς προστίθενται περισσότερα ιόντα Na+ και OH- και η αντίδραση εξουδετέρωσης δεν αφαιρεί πλέον μια αξιόλογη ποσότητα H+.

Συνεπώς, όταν ένα ισχυρό οξύ τιτλοδοτείται με μια ισχυρή βάση, η αγωγιμότητα έχει ένα ελάχιστο στο σημείο ισοδυναμίας. Αυτό το ελάχιστομπορεί να χρησιμοποιηθεί αντί για χρωστική ένδειξης για τον προσδιορισμό του τελικού σημείου μιας ογκομέτρησης. Η καμπύλη τιτλοδότησης είναι ένα γράφημα μετρούμενων τιμών αγωγιμότητας ή αγωγιμότητας ως συνάρτηση του όγκου του προστιθέμενου διαλύματος NaOH. Η καμπύλη ογκομέτρησης μπορεί να χρησιμοποιηθεί για τον γραφικό προσδιορισμό του σημείου ισοδυναμίας. Η αγωγομετρική μέθοδος ανάλυσης (και η χρήση της) είναι εξαιρετικά σημαντική στη σύγχρονη χημεία.
Αντίδραση
Για μια αντίδραση μεταξύ μιας ασθενούς ως προς το οξύ βάσης, η ηλεκτρική αγωγιμότητα πρώτα μειώνεται κάπως, καθώς χρησιμοποιούνται λίγα διαθέσιμα ιόντα Η+. Στη συνέχεια, η αγωγιμότητα αυξάνεται ελαφρώς μέχρι τον όγκο του ισοδυναμικού σημείου λόγω της συμβολής του κατιόντος άλατος και του ανιόντος (αυτή η συμβολή στην περίπτωση ισχυρής όξινης βάσης είναι αμελητέα και δεν υπολογίζεται εκεί.) Αφού επιτευχθεί το σημείο ισοδυναμίας, η αγωγιμότητα αυξάνεται γρήγορα λόγω περίσσειας ιόντων ΟΗ.
Οι ανιχνευτές αγωγιμότητας (αγωγιμότητας μέθοδος ανάλυσης) χρησιμοποιούνται επίσης για τη μέτρηση των συγκεντρώσεων ηλεκτρολυτών σε υδατικά διαλύματα. Η μοριακή συγκέντρωση της αναλυόμενης ουσίας που δημιουργεί την αγωγιμότητα του διαλύματος μπορεί να ληφθεί από τη μετρούμενη ηλεκτρική αντίσταση του διαλύματος.
Αγωγομετρική μέθοδος ανάλυσης: αρχή και τύποι
(2.4.13) C=Constcell1Λm1Res, όπου Constcell είναι μια σταθερή τιμή ανάλογα με το κελί μέτρησης, Res είναι η ηλεκτρική αντίσταση που μετράται από τη συσκευή (σύμφωνα με το νόμο του Ohm Res=I / V και με σταθερή Η μέτρηση τάσης V, η ένταση I σας επιτρέπει να υπολογίσετε το Res), και το Λm είναι το ισοδύναμοαγωγιμότητα για ιοντικά σωματίδια. Αν και για πρακτικούς λόγους το Λm μπορεί να θεωρηθεί σταθερό, εξαρτάται από τη συγκέντρωση σύμφωνα με το νόμο του Kohlrausch:
(2.4.14)=Χτ Λm0-ΘC, όπου Θ είναι μια σταθερά και Λm0 είναι το χαρακτηριστικό περιοριστικής μοριακής αγωγιμότητας κάθε ιόντος. Η μοριακή αγωγιμότητα, με τη σειρά της, εξαρτάται από τη θερμοκρασία.
Scrit
Η ανάπτυξη της αγωγιμότητας μεθόδου ανάλυσης μέτρησης οδήγησε τους επιστήμονες σε νέες ανακαλύψεις. Οι επιστήμονες προσδιόρισαν την κρίσιμη αναλογία υπερκορεσμού, Scrit, χρησιμοποιώντας αγωγιμότητα σε ένα ομοιογενές σύστημα καταβύθισης AgCl σε περίσσεια ιόντων Ag+, χρησιμοποιώντας υδρόλυση αλκυλοχλωριδίου ως πηγή ιόντων CI». Βρήκαν Scrit=1,51, 1,73 και 1,85 στους 15, 25 και 35°C αντίστοιχα, όπου S=([Ag+][Cl-] / Ksp) 1/2 από τον ορισμό τους. Εάν αυτός ο ορισμός του παράγοντα υπερκορεσμού μετατραπεί σε δικό μας (S=[Ag+][Cl-] / Ksp), τα αποτελέσματα είναι 2,28, 2,99 και 3,42, αντίστοιχα, σε αρκετά καλή συμφωνία με τα αποτελέσματα της παρούσας μελέτης. Ωστόσο, η εξάρτηση από τη θερμοκρασία του Scrit είναι αντίθετη από αυτή που περιγράφεται στην παρούσα μελέτη. Αν και ο λόγος αυτής της αντίφασης δεν είναι ξεκάθαρος, η μείωση του Scrit με την αύξηση της θερμοκρασίας μπορεί να είναι αρκετά λογική, καθώς ο ρυθμός πυρήνωσης αλλάζει δραματικά με μια μικρή αλλαγή στο ΔGm/ kT, και επομένως στο ΔGm/ kT, που είναι ανάλογο του T − 3 (lnSm) 2 σύμφωνα με τον τύπο (1.4.12) θεωρείται ότι είναι σχεδόν σταθερό με τη μεταβολή της θερμοκρασίας στο δεδομένο σύστημα. Παρεμπιπτόντως, ο ορισμός του S πρέπει να είναι [Ag +] [Cl -] / Ksp, δεδομένου ότι ο λόγος υπερκορεσμού σε όρουςΗ συγκέντρωση μονομερούς [AgCl] δίνεται αρχικά ως S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp.
Tanaka and Iwasaki
Η ιστορία της αγωγιμότητας μεθόδου ανάλυσης συνεχίστηκε από δύο εμβληματικούς Ιάπωνες επιστήμονες. Οι Tanaka και Iwasaki μελέτησαν τη διαδικασία πυρήνωσης των σωματιδίων AgCl και AgBr χρησιμοποιώντας τη μέθοδο διακοπής ροής σε συνδυασμό με ένα πολυκαναλικό φασματοφωτόμετρο, το οποίο είναι χρήσιμο για τη μελέτη μιας γρήγορης διαδικασίας της τάξης του msec. Βρήκαν ότι κάποιο συγκεκριμένο σύμπλοκο αλογονιδίου αργύρου AgXm (m-1), που είχε μια μάλλον στενή ζώνη απορρόφησης υπεριώδους ακτινοβολίας, σχηματίστηκε αμέσως όταν ένα διάλυμα AgC104 της τάξης των 10-4 mol dm-3 αναμίχθηκε με ένα KX (X=Cl ή Br) διάλυμα της τάξης από 10-2 έως 10-1 mol dm-3 που ακολουθείται από ταχεία διάσπαση περίπου 10 ms με σχηματισμό ενός ενδιάμεσου προϊόντος που έχει ευρεία απορρόφηση UV και πολύ πιο αργή αλλαγή στο φάσμα του ενδιάμεσου προϊόντος. Ερμήνευσαν το ενδιάμεσο ως μονοδιεσπαρμένους πυρήνες (AgX) n που αποτελούνται από n μόρια και προσδιόρισαν το n από τη φαινομενική αναλογία -dC/dt α Cn σε t=0 για διάφορες αρχικές συγκεντρώσεις του πρόδρομου C AgXm (m-1) - (n=7 -10 για AgCl, n=3-4 για AgBr).

Ωστόσο, δεδομένου ότι ο πρόδρομος AgXm (m − 1) διασπάται με μη στάσιμο τρόπο, η θεωρία του οιονεί στατικού πυρήνα δεν εφαρμόζεται σε αυτή τη διαδικασία, και επομένως η προκύπτουσα τιμή του n δεν αντιστοιχεί στο nτιμή των κρίσιμων πυρήνων. Εάν το ενδιάμεσο προϊόν περιέχει μονοδιασπαρμένους πυρήνες,που σχηματίζεται από το μονομερές σύμπλοκο, η αναλογία -dC/dt αC μπορεί να μην διατηρείται. Εκτός αν υποθέσουμε ότι συστάδες μικρότερες από n-μερή βρίσκονται σε ισορροπία, ki − 1, ici − 1c1=ki, i − 1ci, μεταξύ τους σε διαδοχική αντίδραση c1 → c2 → c3 →… → cn − 1 → cn., και μόνο το τελευταίο βήμα cn − 1 → cn είναι μη αναστρέψιμο. δηλ. c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
Εξάλλου, θα πρέπει να υποτεθεί ότι οι συγκεντρώσεις των συστάδων από 2 έως n-1 έχουν αμελητέες συγκεντρώσεις ισορροπίας. Ωστόσο, δεν φαίνεται να υπάρχει βάση για να δικαιολογηθούν αυτές οι υποθέσεις. Από την άλλη πλευρά, προσπαθήσαμε να υπολογίσουμε τις ακτίνες των κρίσιμων πυρήνων και τους συντελεστές υπερκορεσμού S στο τέλος της γρήγορης διαδικασίας, χρησιμοποιώντας γ=101 mJ m − 2 για το κυβικό AgCl19 και γ=109 mJ m − 2 για το κυβικό AgBr20. υποθέτοντας ότι οι τιμές n, 7-10 για AgCl19 και 3-4 για AgBr20, είναι ισοδύναμες με το μέγεθος των μονοδιασπαρμένων πυρήνων, n. Η αγωγομετρική μέθοδος ανάλυσης, οι κριτικές της οποίας κυμαίνονται από την απλή έγκριση έως τον θαυμασμό, έδωσε μια νέα γέννηση στη χημεία ως επιστήμη.
Σαν αποτέλεσμα, οι επιστήμονες ανακάλυψαν τον ακόλουθο τύπο: r=0,451 nm και S=105 για AgCl με n=9; r=0,358 nm και S=1230 για AgBr με n=4. Δεδομένου ότι τα συστήματά τους είναι συγκρίσιμα με αυτά των Davis και Jones, που έλαβαν κρίσιμο υπερκορεσμό AgCl περίπου 1,7-2,0 στους 25 °C. Χρησιμοποιώντας αγωγιμότητα απευθείας ανάμιξης σε ίσους όγκους αραιωμένων υδατικών διαλυμάτων AgNO3 και KCl, οι εξαιρετικά υψηλές τιμές S μπορεί να μην αντικατοπτρίζουν πραγματικούς παράγοντες υπερκορεσμού.σε ισορροπία με ενδιάμεσους πυρήνες.
απορρόφηση UV
Φαίνεται πιο λογικό να αποδοθεί ένα ενδιάμεσο με ευρεία απορρόφηση υπεριώδους ακτινοβολίας σε πολύ μεγαλύτερους από τον μέσο όρο πυρήνες με ευρεία κατανομή μεγέθους που δημιουργείται από μια μη στάσιμη διαδοχική αντίδραση. Η επακόλουθη αργή αλλαγή των ενδιάμεσων πυρήνων φαίνεται να σχετίζεται με την ωρίμανση τους στο Ostwald.

Στο παραπάνω πλαίσιο, ο Αμερικανός χημικός Nielsen εξήγαγε επίσης ένα παρόμοιο nγύρω στο 12 και ένα αντίστοιχο S μεγαλύτερο από 103 για τον πυρήνα των σωματιδίων θειικού βαρίου από μετρήσεις θολότητας ως συνάρτηση του υπερκορεσμού, χρησιμοποιώντας n=dlogJ / dlogC σε μια θεωρία τύπου Becher-Dering στον τύπο. (1.3.37), αλλά δίνοντας (n+ 1) αντί για n. Εφόσον τα διαλύματα ιόντων βαρίου και θειικών ιόντων αναμίχθηκαν απευθείας σε αυτό το πείραμα, η γρήγορη παροδική πυρήνωση θα έπρεπε να είχε τελειώσει αμέσως μετά την ανάμειξη και αυτό που μετρήθηκε θα μπορούσε να είναι ο ρυθμός αργής επακόλουθης ωρίμανσης Ostwald και/ή σύντηξης των παραγόμενων πυρήνων. Προφανώς, αυτός είναι ο λόγος για την αδικαιολόγητα μικρή τιμή του n και τον εξαιρετικά υψηλό υπερκορεσμό. Επομένως, πρέπει να σημειώσουμε ξανά ότι κάποια δεξαμενή μονομερών ειδών που τα απελευθερώνει ως απόκριση στην κατανάλωσή τους είναι πάντα απαραίτητη για την επίτευξη οιονεί στάσιμων πυρήνων σε ένα κλειστό σύστημα. Όλες οι κλασικές θεωρίες πυρηνοποίησης, συμπεριλαμβανομένης της θεωρίας Becher-Döring, υποθέτουν σιωπηρά μια τέτοια προϋπόθεση. Ορισμός αγωγιμότηταςΗ μέθοδος ανάλυσης δόθηκε στις παραπάνω ενότητες του άρθρου.
Άλλοι επιστήμονες έχουν διερευνήσει τη διαδικασία της παροδικής πυρήνωσης του αλογονούχου αργύρου με παλμική ραδιόλυση νερού που περιέχει αλογονίδιο μεθυλενίου και ιόντα αργύρου, κατά την οποία το αλογονίδιο μεθυλενίου αποσυντίθεται για να απελευθερώσει ιόντα αλογονιδίου από ενυδατωμένα ηλεκτρόνια που παράγονται από παλμική ακτινοβολία στην περιοχή από 4 ns έως 3 μs. Τα φάσματα των προϊόντων καταγράφηκαν με χρήση φωτοπολλαπλασιαστή και κάμερα ραβδώσεων και μονομερείς πρόδρομοι αλογονιδίου αργύρου βρέθηκαν να σχηματίζονται σε ένα χρόνο της τάξης των μικροδευτερόλεπτων ακολουθούμενη από μια διαδικασία πυρήνωσης παρόμοια με αυτή που παρατηρήθηκε από τους Tanaka και Iwasaki. Τα αποτελέσματά τους δείχνουν ξεκάθαρα ότι η διαδικασία πυρηνοποίησης των αλογονιδίων του αργύρου με άμεση ανάμειξη των αντιδρώντων αποτελείται από δύο στοιχειώδη στάδια. δηλαδή ο σχηματισμός ενός μονομερούς προδρόμου της τάξης των μs και η επακόλουθη μετάβαση σε πυρήνες της τάξης των 10 ms. Πρέπει να σημειωθεί ότι το μέσο μέγεθος των πυρήνων είναι περίπου 10 nm.
Κορεσμός
Σχετικά με τους συντελεστές υπερκορεσμού για την πυρήνωση των σωματιδίων AgCl σε ανοιχτά συστήματα στα οποία υψηλές συγκεντρώσεις αντιδρώντων όπως AgNO3 και KCl εισάγονται συνεχώς στο διάλυμα ζελατίνης καθ' όλη τη διάρκεια της καθίζησης, οι Strong και Wey31 ανέφεραν 1,029 (80° C) - 1.260 (40°C) και Leubner32 ανέφεραν 1.024 στους 60°C όπως εκτιμήθηκε από τη μέτρηση του ρυθμού ανάπτυξης των σωματιδίων σπόρων AgCl σε κρίσιμο υπερκορεσμό. Αυτή είναι η ουσία της αγωγομετρικής μεθόδου ποσοτικής ανάλυσης.
Από την άλλη πλευρά, για ανοιχτά συστήματα σωματιδίων AgBr, μερικάεκτιμώμενες τιμές του κρίσιμου συντελεστή υπερκορεσμού, Scrit: Scrit∼- 1,5 στους 70 °C σύμφωνα με τους Wey και Strong33 από τον εξαρτώμενο από το μέγεθος μέγιστο ρυθμό ανάπτυξης που προσδιορίζεται με την εύρεση του ορίου επαναπυρήνωσης σε διαφορετικούς ρυθμούς προσθήκης διαλύματος AgNO3 σε KBr διάλυμα παρουσία σωματιδίων σπόρων με διπλούς πίδακες. Scrit=1,2-1,5 στους 25°C σύμφωνα με τους Jagannathan και Wey34 ως ο μέγιστος παράγοντας υπερκορεσμού που προσδιορίζεται από την εξίσωση Gibbs-Thomson με τα δεδομένα τους σχετικά με το ελάχιστο μέσο μέγεθος πυρήνων που παρατηρείται με ηλεκτρονικό μικροσκόπιο κατά τη διάρκεια του βήματος πυρήνωσης της κατακρήμνισης AgBr με δύο πίδακες. Αυτό είναι πολύ αποτελεσματικό όταν εφαρμόζεται η μέθοδος αγωγιμότητας ποσοτικοποίησης.

Κατά τον υπολογισμό αυτών των τιμών Scrit, πήραν γ=140 mJ m − 2. Δεδομένου ότι η πυρήνωση σε ανοιχτά συστήματα αντιστοιχεί στη διαδικασία επιβίωσης των εκκολαπτόμενων πυρήνων που δημιουργούνται σε μια τοπική ζώνη εξαιρετικά υψηλού υπερκορεσμού κοντά στις εξόδους των αντιδραστηρίων, είναι κρίσιμη Ο υπερκορεσμός αντιστοιχεί στη συγκέντρωση της διαλυμένης ουσίας σε ισορροπία με πυρήνες μέγιστου μεγέθους, εάν χρησιμοποιήσουμε τα δεδομένα του Sugimoto35 για τη μέγιστη ακτίνα των πυρήνων AgBr σε ανοιχτά συστήματα (0,3 8,3 nm) με θεωρητικό γ για κυβικό AgBr (=109 mJ m − 2) 3, τότε ο κρίσιμος συντελεστής υπερκορεσμού, Scrit, υπολογίζεται όπως θα ήταν 1,36 στους 25°C (εάν το γ υποτεθεί ότι είναι 140 mJ/m2, τότε Scrit=1,48).
Συνεπώς, σε κάθε περίπτωση, κρίσιμοι υπερκορεσμοί σεΤα ανοιχτά συστήματα σωματιδίων αλογονιδίου του αργύρου είναι συνήθως πολύ κάτω από τους μέγιστους υπερκορεσμούς (πιθανώς κοντά σε κρίσιμους υπερκορεσμούς) σε κλειστά συστήματα. Αυτό οφείλεται στο γεγονός ότι η μέση ακτίνα των πυρήνων που παράγονται στην τοπική ζώνη ενός ανοιχτού συστήματος είναι πολύ μεγαλύτερη από το rmσε ένα κλειστό σύστημα, πιθανώς λόγω της στιγμιαίας σύντηξης των εξαιρετικά συγκεντρωμένων πρωτογενών πυρήνων στην τοπική ζώνη ενός ανοιχτού συστήματος με υψηλή τοπική συγκέντρωση ηλεκτρολυτών.
Αίτηση
Η χρήση της μεθόδου αγωγιμότητας τιτλοδότησης για συνεχή καταγραφή κατά τη διάρκεια ενζυματικών διεργασιών έχει μελετηθεί και αναλυθεί εκτενώς. Σχεδόν όλες οι ηλεκτροχημικές μέθοδοι ανάλυσης βασίζονται σε ηλεκτροχημικές αντιδράσεις (ποτενσιομετρία, βολταμετρία, αμπερομετρία, κουλομετρία).
Η αγωγομετρική μέθοδος ανάλυσης είναι μια μέθοδος στην οποία είτε δεν υπάρχουν καθόλου ηλεκτροχημικές αντιδράσεις στα ηλεκτρόδια είτε υπάρχουν δευτερεύουσες αντιδράσεις που μπορούν να παραβλεφθούν. Επομένως, σε αυτή τη μέθοδο, η πιο σημαντική ιδιότητα του διαλύματος ηλεκτρολύτη στο οριακό στρώμα είναι η ηλεκτρική του αγωγιμότητα, η οποία ποικίλλει ανάλογα με ένα αρκετά ευρύ φάσμα βιολογικών αντιδράσεων.
Πλεονεκτήματα
Οι αγωγομετρικοί βιοαισθητήρες έχουν επίσης ορισμένα πλεονεκτήματα σε σχέση με άλλους τύπους μορφοτροπέων. Πρώτον, μπορούν να κατασκευαστούν χρησιμοποιώντας τεχνολογία λεπτής μεμβράνης χαμηλού κόστους. Αυτό, μαζί με τη χρήση μιας βελτιστοποιημένης μεθόδου για την ακινητοποίηση βιολογικού υλικού, οδηγεί σε σημαντική μείωση τόσο του πρωτογενούς κόστους των συσκευών όσο καισυνολικό κόστος ανάλυσης. Για τους ενσωματωμένους μικροβιοαισθητήρες, είναι εύκολο να εκτελέσετε τη λειτουργία διαφορικής μέτρησης, η οποία αντισταθμίζει τις εξωτερικές επιρροές και βελτιώνει σημαντικά την ακρίβεια μέτρησης.
Τα δεδομένα δείχνουν ξεκάθαρα τις μεγάλες δυνατότητες των αγωγομετρικών βιοαισθητήρων. Ωστόσο, αυτή είναι μια αρκετά νέα τάση στους βιοαισθητήρες, επομένως η ανάπτυξη εμπορικών συσκευών έχει ένα πολλά υποσχόμενο μέλλον.
Νέες μέθοδοι
Μερικοί επιστήμονες έχουν περιγράψει μια γενική μέθοδο για τη μέτρηση του pKa με αγωγιμότητα. Αυτή η μέθοδος χρησιμοποιήθηκε ευρέως μέχρι το 1932 περίπου (πριν χρησιμοποιούνται μέθοδοι μέτρησης του pH). Η αγωγομετρική μέθοδος είναι εξαιρετικά ευαίσθητη στη θερμοκρασία και δεν μπορεί να χρησιμοποιηθεί για τη μέτρηση επικαλυπτόμενων τιμών pKa. Ένα πιθανό πλεονέκτημα για δείγματα χωρίς χρωμοφόρο είναι ότι μπορεί να χρησιμοποιηθεί σε πολύ αραιά διαλύματα, μέχρι 2,8 × 10-5 M. Τα τελευταία χρόνια, η αγωγιμότητα 87 έχει χρησιμοποιηθεί για τη μέτρηση του pKa της λιδοκαΐνης, αν και το αποτέλεσμα που λήφθηκε ήταν 0,7 ανά μονάδα κάτω από τη γενικά αποδεκτή τιμή pH.

Ο Albert και ο Sergeant περιέγραψαν επίσης μια μέθοδο για τον προσδιορισμό του pKa από μετρήσεις διαλυτότητας. Όπως αναφέρθηκε παραπάνω, η διαλυτότητα εξαρτάται από το pKa, επομένως εάν η διαλυτότητα μετρηθεί σε πολλαπλές τιμές pH σε μια καμπύλη, το pKa μπορεί να προσδιοριστεί. Οι Peck και Benet περιέγραψαν μια γενική μέθοδο για τον υπολογισμό των τιμών pKa για μονοπρωτικές, διπρωτικές και αμφοτερικές ουσίες με βάση ένα σύνολο μετρήσεων διαλυτότητας και pH. Οι Hansen και Hafliger έλαβαν το pKa του δείγματος, το οποίοαποσυντίθεται γρήγορα με υδρόλυση από τους αρχικούς ρυθμούς διάλυσής του ως συνάρτηση του pH σε μια συσκευή περιστρεφόμενου δίσκου. Το αποτέλεσμα συμφωνεί καλά με το αποτέλεσμα pH/UV, αλλά η αποσύνθεση καθιστά δύσκολη την τελευταία μέθοδο. Αυτή είναι, σε γενικές γραμμές, μια περιγραφή της αγωγιμότητας μεθόδου ανάλυσης.






